
Nyt projekt vil studere molekyler, der kan forklare, hvorfor du er lige præcis dig
I løbet af dit liv kan der opstå alle mulige påvirkninger, som tænder og slukker for mange af dine gener og dermed skaber de variationer, der gør dig til lige præcis dig. Professor i kemi, Jasmin Mecinovic, vil helt ned i den molekylære verden for at forstå dem.
De fleste ved, at vores DNA, vores arvemateriale, har en afgørende rolle for, hvordan vi udvikler os, hvordan vi ser ud, hvilke sygdomme, vi er i risiko for at få, osv. Dette DNA findes i hver eneste af vores celler, og det ændrer sig ikke; når en celle deler sig for at forny sig selv, tager den en præcis kopi af sit DNA med. Men hvis hver eneste celle starter ud med den samme DNA, hvordan kan det så være, at alle celler ikke udvikler sig ens?
Det er det, som videnskaben kalder et rigtigt godt spørgsmål, og i disse år er mange forskere optaget af epigenetikken; altså at faktorer udefra i kortere eller længere tid kan ændre på, hvordan en celles ellers uforanderlige gener kan variere i udtryk.
Faktorerne kan fx være den mad, vi spiser, den motion, vi dyrker, eller at vi bliver ældre. Nogle forskere mener også, at epigenetiske ændringer kan overføres fra forældrene til det ufødte barn, så barnet allerede i fostertilstanden så at sige kodes til at håndtere det miljø, som moderen eller faderen er udsat for. Nogle forskere mener yderligere, at også psykiske påvirkninger som fx stress og traumer hos en forælder kan føre til epigenetiske ændringer i et ufødt barn, fx forhøjet niveau af stresshormoner.
Epigenetiske ændringer er ikke varige og forsvinder igen.
Om projektet
Jasmin Mecinovic har modtaget 13.209.000 kr. fra Novo Nordisk Fonden til projektet ''Understanding the Chemical Language of Linker Histones'.
Molekyler er basis for alt levende
- Alt liv er molekylært i sin basis. Så ideen om, at organismer også på molekylært niveau reagerer på påvirkninger, er logisk. Jeg er kemiker og interesserer mig for, hvad der foregår på det molekylære niveau, når der indtræffer en bestemt epigentisk påvirkning af et gen, siger Jasmin Mecinovic.
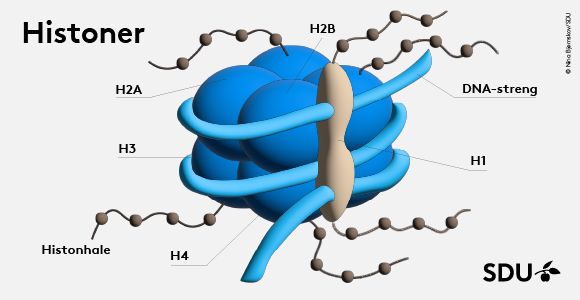
Epigentiske påvirkninger – om de er tilsigtede fra naturen eller udløst af miljøpåvirkninger - igangsætter kemiske ændringer af nogle strukturer, der ligger omkring selve DNA’et inde i hver eneste cellekerne. Disse strukturer kaldes histoner, og deres primære funktion er at udgøre et skelet, som de to meter lange DNA-strenge kan vikles op om.
Men de har også billedligt talt en hale, der stikker uden for DNA’et. Den kan enzymer sætte sig fast på. Når enzymer gør det, afstedkommer det, at der bliver sendt besked gennem histonet ind i cellekernen om, at der skal tændes eller slukkes for nogle af de gener, der ligger derinde.
Et genom består af en organismes samlede genetiske materiale og indeholder ekstremt meget information – de fleste har nok hørt om baserne A, C, G og T, der i de to DNA-strenge kan kobles på et utal af måder. Hver forbindelse bliver til et unikt gen, som på sin side afgør, hvilken funktion, en celle skal have i en organisme. Groft sagt er basernes sammensætning ansvarlig for, om du bliver mørkhåret, højrehåndet eller udvikler seks tæer på fødderne.
- Et menneskeligt genom indeholder mindst 20.000 gener og er dermed ligesom en bog på 20.000 sider, der indeholder en masse information, men ikke alt er i spil på samme tid. Lad os lege, at vi begge to har en kopi af den bog. Jeg slår op på side 10, og du slår op på side 100. Vi får to forskellige stykker information fra samme kilde. Sådan er det også med gener; der er ikke altid adgang til det hele, kun enkelte dele bliver aktiveret. Og den aktivering kan altså foranlediges af proteiner, der kan hæfte, fjerne eller genkende små kemiske tags på histonerne, forklarer Jasmin Mecinovic.
Hvor og hvordan, enzymer sætter disse tags på histonerne, og hvordan sådanne ændringer kontrollerer de genetiske udtryk – det er et kæmpe puslespil, som forskerne kun i de seneste ca. 30 år har haft mulighed for at udforske. Ændringerne er nemlig så små, at det har krævet ekstremt avancerede kemiske værktøjer at kigge ind i histonernes verden.
Flagrer rundt med spaghetti-arme
Af samme årsag har man indtil nu beskæftiget sig mest med de fire kernehistoner, som DNA-strengene vikler sig om. Men der findes et femte histon, kaldet linker H1, som er så uregerligt, at det indtil for ganske nyligt har været umuligt at studere med eksisterende teknikker.
- Forestil dig, at dette histon har spaghettiarme, der hele tiden flagrer rundt, og hvor svært det er at tage et billede af det; Det er ligesom hvis jeg vifter med hånden, mens du tager et billede: det bliver utydeligt. Men nu eksisterer dette histon altså i mennesket og andre komplekse livsformer, så det må have en vigtig funktion, og det er det, som jeg gerne vil undersøge, siger Jasmin Mecinovic.
En af opgaverne for Jasmin Mecinovic’s forskningsgrupper bliver at udvikle nogle kemiske metoder, som overhovedet gør det muligt at se, hvad der foregår i de epigenetiske kringelkroge af det uregerlige H1-histon.
Skyld i sygdomme
Ligesom de øvrige histoner har H1 også en hale, der sidder udenfor DNA’et. Også den kan blive modificeret af enzymer, så der via H1 kan opstå ændringer på generne inde i cellekernen.
- En anden vigtig opgave bliver at forsøge at bygge H1 histoner, som vi kan modificere specifikt til at ligne naturlige H1 histoner for så at se, hvilken effekt, det kan få på interaktionen med histoner, epigenetiske proteiner og DNA, forklarer Jasmin Mecinovic.
At studere hvordan H1 histoner interagerer med andre biomolekyler på molekylært niveau, er kemisk grundforskning. Men det er også sygdoms- og medicinal-relateret forskning, fordi histonerne kan forårsage uhensigtsmæssige aktiveringer eller slukninger af gener og dermed føre til sygdomme som visse kræftsygdomme og autoimmune sygdomme som leddegigt, lupus, type 1 diabetes og multipel sclerose.
Mød forskeren
Jasmin Mecinovic er professor i kemi på Institut for Fysik, Kemi og Farmaci. Efter studier på Oxford og Harvard kom han til SDU i 2018. Hans gruppe bruger kemi til at forstå biologiske processer på det molekylære niveau. Hans forskning støttes pt. af Novo Nordisk Fonden, Lundbeckfonden og Danmarks Frie Forskningsråd.